Reaktoren für EC/MS
Die Online-Kopplung der Elektrochemie (EC) mit der Massenspektrometrie (MS) hat großes Potenzial für die Untersuchung des Arzneimittelstoffwechsels in Arzneimitteln und für die Strukturaufklärung von Biopharmazeutika und Proteinen gezeigt. Wie der Titel schon sagt, besteht die Technik aus zwei Teilen. Zunächst der elektrochemische Reaktor, in dem die Produkte oder Metaboliten gebildet werden. Zweitens, das MS, in dem die Produkte identifiziert und in einigen Fällen quantifiziert werden.

Abb. 1. Eine Spritzenpumpe und ein Potentiostat mit einem EC-Reaktor darin.
Elektrochemischer Reaktor
In einem elektrochemischen Durchflussreaktor wird eine Substratlösung mit Hilfe einer Spritzenpumpe zugeführt. Der Reaktor ist eigentlich eine elektrochemische Zelle, an deren Elektroden ein geringes Potenzial angelegt wird, um die Reaktion anzutreiben. Der Ausgang der Zelle ist mit einem MS zur Analyse der Produkte verbunden.
Es gibt mehrere Parameter, die für ein erfolgreiches EC/MS-Experiment wichtig sind. Der erste ist das angelegte Potenzial, das die Energie liefert, um eine Reaktion in Gang zu setzen. Ein positives Potenzial für Oxidations- und ein negatives für Reduktionsreaktionen. Wenn die Bedingungen einmal festgelegt sind und die Reaktion abläuft, wird eine weitere Erhöhung des Potenzials die Reaktion nicht beschleunigen oder mehr Produkt erzeugen. Der Grund dafür ist in den Gesetzen der Elektrochemie zu finden. Der begrenzende Faktor ist nicht das Potenzial, sondern die Diffusion des Substrats aus der Lösung zur Elektrode.
Der zweite wichtige Parameter ist die Zusammensetzung des Lösungsmittels. Es kann einen großen Unterschied machen, ob der pH-Wert oder der Prozentsatz des organischen Lösungsmittels stimmt. Bei der Reduktion von Proteinen zum Beispiel wird Ameisensäure verwendet, um den pH-Wert einzustellen. Aber auch, weil sie ein reaktives Zwischenprodukt auslöst, das die Reaktion katalysiert, ausführlicher beschrieben von B. Stocks und J. Melanson (2019).
Auch die Durchflussrate ist wichtig, denn bei einer geringeren Durchflussrate wird in der Regel ein relativ großer Prozentsatz des Substrats in ein Produkt umgewandelt. Die Größe der Elektroden und die Abstände zwischen den Elektroden sind weitere Faktoren, die eine Rolle spielen.
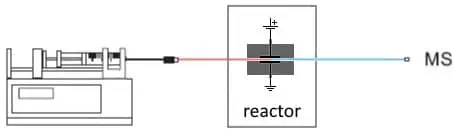
Abb. 2. Einfachste Konfiguration für EC/MS. Eine Spritzenpumpe liefert das Substrat. Im EC-Reaktor werden Oxidations- oder Reduktionsprodukte gebildet und in einem MS analysiert.
Massenspektrometrie
Die Reaktionsprodukte werden mit dem Massenspektrometer analysiert. Diese Online-Kopplung hat mehrere Vorteile. Erstens ist sie äußerst schnell. In der Regel werden die Reaktionsprodukte innerhalb von 15 Sekunden mittels MS analysiert. Zweitens ist das Lösungsmittel viel sauberer als bei alternativen Methoden. Herkömmliche Methoden erfordern häufig die Zugabe von Chemikalien oder Enzymen, und vor der Analyse in einem MS ist ein Reinigungsschritt erforderlich. Drittens ist es mit einem Online-Setup einfacher, einen Arbeitsablauf zu automatisieren oder einen Make-up-Flow zu verwenden und Substrate hinzuzufügen oder den pH-Wert des Lösungsmittels anzupassen und die MS-Empfindlichkeit zu verbessern.
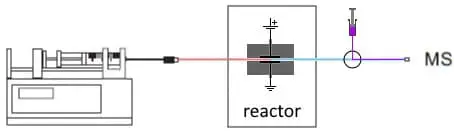
Abb. 3. On-line EC/MS-Konfiguration zur Untersuchung der Konjugation. Nach dem Reaktor wird ein Make-Up-Fluss mit Substrat zugeführt.
Studien über pharmazeutische Metaboliten
Auf der rechten Seite ist ein Beispiel für die EC/MS von Amodiaquin (AQ) dargestellt. Die m/z-Spur von AQ verschwindet und die Metabolitenspuren erscheinen, wenn der Reaktor eingeschaltet wird. Innerhalb von 5 Minuten werden alle bekannten Metaboliten von AQ gefunden und identifiziert. Weitere Einzelheiten finden Sie in unserer Applikation.
Die Technik bietet eine schnelle elektrochemische Synthese von Arzneimittelmetaboliten zur Identifizierung und Quantifizierung durch Massenspektrometrie (MS). Die Technik kann in einer Durchflusskonfiguration betrieben werden, wodurch sie in einem automatisierten Arbeitsablauf oder als Hochdurchsatz-Screening-System eingesetzt werden kann.
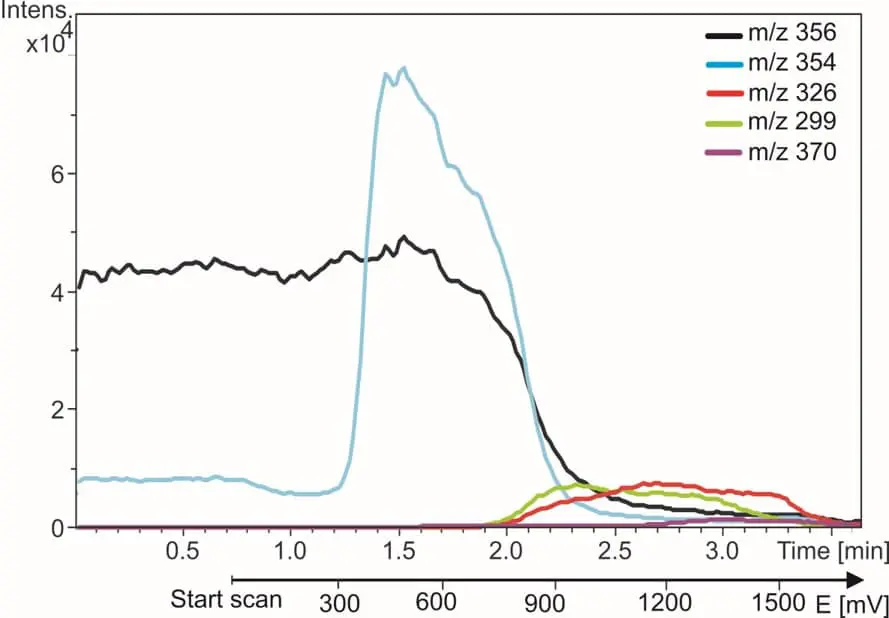
Abb. 3. Das Malariamittel Amodiaquin (schwarze Kurve) und seine Oxidationsprodukte. Die m/z-Spuren werden aufgezeichnet, während das Reaktorpotential von 0 auf 2 Volt erhöht wird.
Strukturaufklärung von Proteinen
Ein weiteres Anwendungsgebiet der EC/MS ist der schnell wachsende Bereich der biopharmazeutischen Forschung. Biopharmazeutika sind Arzneimittel, die mit Hilfe der Biotechnologie in lebenden Systemen hergestellt werden. Es handelt sich um komplexe Proteine mit hohem Molekulargewicht wie Fusionsproteine, Bioaffinitätsproteine, Antikörper (mAbs) und Antikörper-Wirkstoff-Konjugate (ADCs).
Mit der wachsenden Zahl von Biopharmazeutika, die auf den Markt kommen, steigt der Bedarf an effizienten und automatisierten Strategien zur Strukturaufklärung. Das kann eine ziemliche Herausforderung sein. Es ist nicht nur die Primärstruktur, die Zuordnung der Aminosäuren, die wichtig ist. Sie betrifft auch die Struktur höherer Ordnung (HOS), die durch interne Disulfidbrücken und posttranslationale Modifikationen wie Phosphorylierungen, Acetylierungen, Glykosylierungen usw. definiert ist. Die Struktur bestimmt die biologische Aktivität (Übersicht: D. Virág et al, 2020).
Disulfidbindungen in Proteinen sorgen für Stabilität und Faltung und sind daher von zentraler Bedeutung für die biologische Funktionalität. Bei monoklonalen Antikörpern beispielsweise halten die Disulfidbindungen die kleinen und schweren Ketten zusammen. Daher ist es wichtig, die Lage und Konnektivität von Disulfiden in Proteintherapeutika zu überprüfen. Dies geschieht in der Regel durch Reduktion der Disulfidbindungen und Analyse der Veränderungen in den MS-Spektren (Übersicht: J. Lakudb et al, 2018).
Die elektrochemische Reduktion kann einen solchen Arbeitsablauf automatisieren, indem ein EC-Reaktor in einem Online-Setup in Verbindung mit einem MS verwendet wird. Dies ist ein kleiner, aber bedeutender Schritt in der Herausforderung der Strukturaufklärung von Biopharmazeutika(C. Cramer at al, 2015).

Abb. 5. Disulfidbindungen (gelb) spielen eine wichtige Rolle in der Struktur eines Antikörpers.
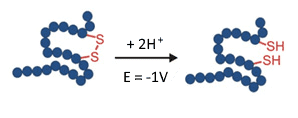
Abb. 6. Reduktion (Aufbrechen) einer Disulfidbindung in einem EC-Reaktor bei -1 V.
Anwendungen
Siehe auch eine Videoaufzeichnung des ASMS-Vortrags von Prof. Uwe Karst (2010) und eine Computeranimation, die die traditionelle Methode mit der EC/MS-Methode für Metabolitenstudien vergleicht.