Ingegneria degli anticorpi
Ingegneria anticorpale mediante elettrochimica
- Riduzione, coniugazione e riossidazione elettrochimica degli anticorpi
- Tecnologia verde – elettroni al posto di sostanze chimiche tossiche
- Selettivo – genera catene leggere e pesanti
- Veloce – pochi secondi rispetto alle ore necessarie per gli approcci chimici (ad es. TCEP, DTT).
Questo nuovo approccio elettrochimico fornisce un metodo rapido ed efficiente per la riduzione selettiva, la coniugazione e la riossidazione degli anticorpi senza la necessità di sostanze chimiche riducenti. La riduzione degli anticorpi nelle sue catene leggere (Lc) e pesanti (Hc) avviene con il metodo elettrochimico precedentemente pubblicato, basato su impulsi di potenziale a onda quadra applicati all’elettrodo Ti proprietario di Antec. Successivamente, la cisteina libera generata dalla riduzione elettrochimica dell’anticorpo può essere coniugata. Infine, la cisteina libera su Lc e Hc può essere riossidata molto rapidamente e selettivamente per riformare l’anticorpo in alte rese. Il trattamento elettrochimico non ha influito sull’affinità di legame degli anticorpi, eliminando la necessità di utilizzare prodotti chimici aggressivi e di effettuare ulteriori e noiose operazioni di pulizia.
Per maggiori dettagli: vedere anche la nostra pagina dedicata alla tecnologia.
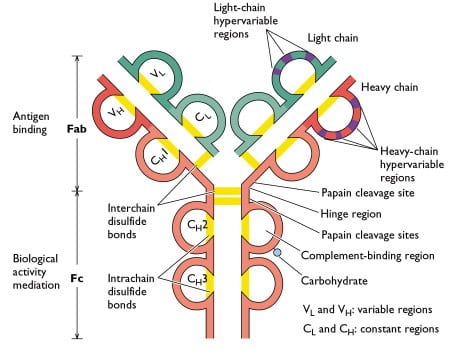
Rappresentazione grafica di un anticorpo con legami disolfuro che tengono insieme le catene pesanti e leggere. La rottura di un legame disolfuro in un reattore elettrochimico a flusso passante richiede un potenziale di circa -1 V.
Spettri di massa
La riduzione elettrochimica dei legami disolfuro si rivelerà probabilmente un importante progresso tecnologico non solo nell’analisi degli anticorpi, ma anche nella progettazione di nuovi terapeutici a base di anticorpi, come anticorpi bi-specifici o coniugati anticorpo-farmaco. Gli spettri MS sotto riportati mostrano i prodotti di reazione (Lc e Hc) dopo l’accensione della cella di reazione (B e D).
Infusione di una soluzione di anticorpi acidificata nello spettrometro di massa con μ-PrepCell spento. (A) ha dato luogo a un inviluppo di cariche che si diffonde tra m/z 2200 e 4000, con l’anticorpo intatto che trasporta circa 40-60 cariche. Quando la cella è stata accesa (B), è stato osservato uno spostamento dell’inviluppo di carica dell’anticorpo verso m/z inferiori (~1000-2500).
Lo spettro (C) deriva dalla deconvoluzione del segnale MS (A) ottenuto con la cella OFF e conferma che l’anticorpo è intatto. D è stato ottenuto con la cellula accesa e mostra soprattutto specie con pesi molecolari di circa 25 e 50 kDa, corrispondenti alle masse di Lc e Hc. L’intensità molto bassa del segnale MS per le specie con peso molecolare superiore a 50 kDa conferma ulteriormente la riduzione selettiva dei legami disolfuro intercatena degli anticorpi in alte rese.
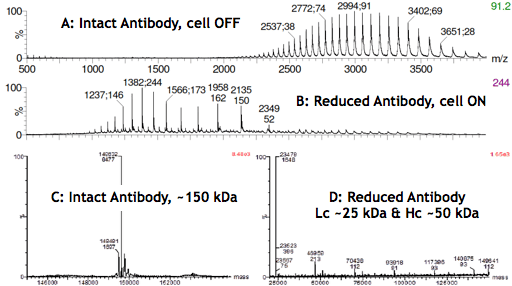
Spettri di massa ad alta risoluzione di un anticorpo monoclonale prima/dopo la riduzione elettrochimica dei legami disolfuro.
Test di legame ELISA
Le curve ottenute in ELISA per tre diversi anticorpi – in forma nativa (verde), ridotta elettrochimicamente e riossidata (rosso e blu) – mostrano un eccellente accordo, illustrando che il trattamento elettrochimico degli anticorpi non influisce sulla loro attività di legame né sulla loro attività biologica, anche quando si mantiene l’anticorpo ridotto per diverse ore in ambiente acido.
Per gentile concessione di Xin Cheng e Arielle Verdi (Morphotek Inc., Exton, PA).

Valutazione dell’affinità di legame del ligando mediante ELISA.
Reattori elettrochimici per MS e sintesi
Metabolismo dei farmaci
Degrado ambientale
Lipidomica, ossidazione dei lipidi
Note applicative
Poster