Reattori per EC/MS
L’accoppiamento on-line dell’elettrochimica (EC) con la spettrometria di massa (MS) ha mostrato un grande potenziale per l’indagine del metabolismo dei farmaci e per l’elucidazione della struttura di biofarmaci e proteine. Come suggerisce il titolo, la tecnica si compone di due parti. In primo luogo, il reattore elettrochimico dove si formano i prodotti o i metaboliti. In secondo luogo, lo SM dove i prodotti sono identificati e in alcuni casi quantificati.

Fig. 1. Una pompa a siringa e un potenziostato con un reattore EC all’interno.
Reattore elettrochimico
In un reattore elettrochimico a flusso continuo viene introdotta una soluzione di substrato mediante una pompa a siringa. Il reattore è in realtà una cella elettrochimica, con un piccolo potenziale applicato agli elettrodi per guidare la reazione. L’uscita della cella è collegata a un MS per l’analisi dei prodotti.
Esistono diversi parametri importanti per il successo di un esperimento EC/MS. Il primo è il potenziale applicato, che fornisce l’energia per far avvenire una reazione. Un potenziale positivo per le reazioni di ossidazione e negativo per quelle di riduzione. Una volta che le condizioni sono state stabilite e la reazione è avvenuta, aumentare ulteriormente il potenziale non accelererà la reazione o genererà più prodotto. Il motivo è spiegato dalle leggi tradizionali dell’elettrochimica. Il fattore limitante non è il potenziale, ma la diffusione del substrato dalla soluzione bulk all’elettrodo.
Il secondo parametro importante è la composizione del solvente. Può fare un’enorme differenza avere il pH corretto o la percentuale di solvente organico. Per la riduzione delle proteine, ad esempio, si usa l’acido formico per impostare il pH. Ma anche perché innesca un intermedio reattivo che catalizza la reazione, descritto in dettaglio da B. Stocks e J. Melanson (2019).
Anche la portata è importante: in genere, con una portata inferiore, una percentuale relativamente maggiore del substrato viene convertita in prodotto. Le dimensioni degli elettrodi e la distanza tra gli elettrodi sono altri fattori che svolgono un ruolo importante.
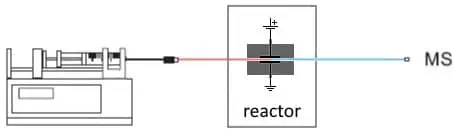
Fig. 2. Configurazione di base per EC/MS. Una pompa a siringa fornisce il substrato. Nel reattore EC si formano prodotti di ossidazione o riduzione che vengono analizzati in un MS.
Spettrometria di massa
I prodotti di reazione vengono analizzati nello spettrometro di massa. Questo accoppiamento in linea presenta diversi vantaggi. Innanzitutto, è molto veloce. In genere, entro 15 secondi i prodotti di reazione vengono analizzati con la MS. In secondo luogo, il solvente è molto più pulito rispetto ai metodi alternativi. I metodi tradizionali richiedono spesso l’aggiunta di sostanze chimiche o enzimi e una fase di pulizia prima dell’analisi in una MS. In terzo luogo, con un’impostazione on-line è più facile automatizzare un flusso di lavoro o utilizzare un flusso di reintegro e aggiungere substrati o regolare il pH del solvente e migliorare la sensibilità della MS.
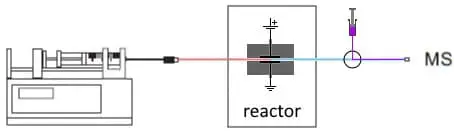
Fig. 3. Configurazione EC/MS in linea per studiare la coniugazione. Dopo il reattore viene aggiunto un flusso di reintegro con substrato.
Studi sui metaboliti farmaceutici
A destra è mostrato un esempio di EC/MS dell’amodiachina (AQ). La traccia m/z di AQ scompare e le tracce dei metaboliti appaiono quando il reattore viene acceso. In 5 minuti vengono trovati e identificati tutti i metaboliti noti di AQ. Maggiori dettagli sono riportati nella nostra nota applicativa.
La tecnica offre una rapida sintesi elettrochimica dei metaboliti dei farmaci per l’identificazione e la quantificazione mediante spettrometria di massa (MS). La tecnica può essere utilizzata in configurazione flow-through, il che ne rende possibile l’implementazione in un flusso di lavoro automatizzato o come sistema di screening ad alta produttività.
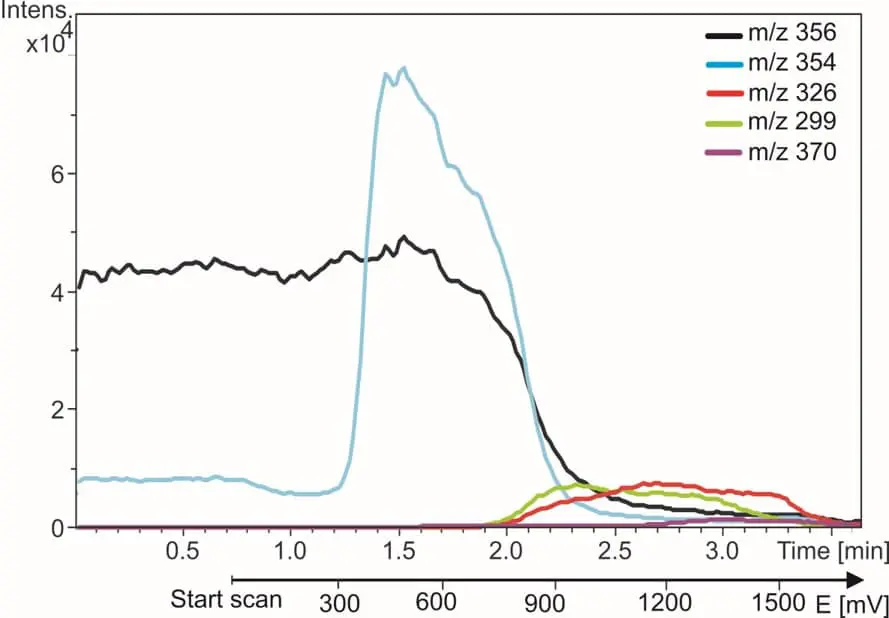
Fig. 3. Il farmaco antimalarico amodiachina (traccia nera) e i suoi prodotti di ossidazione. Le tracce m/z vengono monitorate mentre il potenziale del reattore viene incrementato da 0 a 2 Volt.
Elucidazione della struttura delle proteine
Un’altra area di applicazione dell’EC/MS è il settore in rapida crescita della ricerca biofarmaceutica. I biofarmaci sono farmaci prodotti in sistemi viventi grazie alle biotecnologie. Si tratta di proteine complesse ad alto peso molecolare, come proteine di fusione, proteine di bioaffinità, anticorpi (mAbs) e coniugati anticorpo-farmaco (ADC).
Con il crescente numero di biofarmaci che appaiono sul mercato, cresce la domanda di strategie efficienti e automatizzate per l’elucidazione strutturale. Può essere una bella sfida. Non è importante solo la struttura primaria, la mappatura degli aminoacidi. Riguarda anche la struttura di ordine superiore (HOS) definita dai ponti disolfuro interni e dalle modifiche post-traduzionali come fosforilazioni, acetilazioni, glicosilazioni e così via. La struttura è ciò che definisce l’attività biologica (revisione: D. Virág et al, 2020).
I legami disolfuro nelle proteine garantiscono la stabilità e il ripiegamento e sono quindi di fondamentale importanza per la funzionalità biologica. Negli anticorpi monoclonali, ad esempio, i legami disolfuro tengono insieme le catene piccole e pesanti. È quindi importante verificare la posizione e la connettività dei disolfuri nei farmaci proteici. Questo viene solitamente fatto riducendo i legami disolfuro e analizzando i cambiamenti negli spettri MS (revisione: J. Lakudb et al, 2018).
La riduzione elettrochimica può automatizzare questo flusso di lavoro, utilizzando un reattore EC in una configurazione on-line in connessione con una MS. Si tratta di un piccolo ma significativo passo avanti nella sfida per l’elucidazione della struttura dei biofarmaci(C. Cramer at al, 2015).

Fig. 5. I legami disolfuro (giallo) svolgono un ruolo importante nella struttura di un anticorpo.
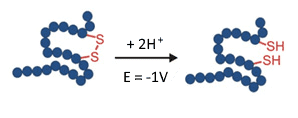
Fig. 6. Riduzione (rottura) di un legame disolfuro in un reattore EC a -1 V.
Applicazioni
Si veda anche la registrazione video della presentazione ASMS del prof. Uwe Karst (2010) e un’animazione computerizzata che confronta il metodo tradizionale con quello EC/MS per gli studi sui metaboliti.