Reactores para EC/MS
El acoplamiento en línea de la electroquímica (EC) con la espectrometría de masas (MS) ha mostrado un gran potencial para la investigación del metabolismo de fármacos y para la elucidación de estructuras de biofármacos y proteínas. Como sugiere el título, la técnica consta de dos partes. En primer lugar, el reactor electroquímico donde se forman los productos o metabolitos. En segundo lugar, la EM en la que se identifican los productos y, en algunos casos, se cuantifican.

Fig. 1. Una bomba de jeringa y un potenciostato con un reactor EC en su interior.
Reactor electroquímico
En un reactor electroquímico de flujo continuo se introduce una solución de sustrato mediante una bomba de jeringa. El reactor es en realidad una célula electroquímica, tiene un pequeño potencial aplicado sobre los electrodos para impulsar la reacción. La salida de la célula se conecta a un MS para el análisis de los productos.
Hay varios parámetros que son importantes para el éxito de un experimento EC/MS. El primero es el potencial aplicado, que suministra la energía para que se produzca una reacción. Un potencial positivo para las reacciones de oxidación y negativo para las de reducción. Una vez establecidas las condiciones y producida la reacción, aumentar aún más el potencial no acelerará la reacción ni generará más producto. La razón de ello se explica en las leyes tradicionales de la electroquímica. El factor limitante no es el potencial, sino la difusión del sustrato desde la solución a granel hasta el electrodo.
El segundo parámetro importante es la composición del disolvente. Puede suponer una gran diferencia tener el pH o el porcentaje de disolvente orgánico correctos. Para la reducción de proteínas, por ejemplo, se utiliza ácido fórmico para fijar el pH. Pero también porque desencadena un intermediario reactivo que cataliza la reacción, descrita con más detalle por B. Stocks y J. Melanson (2019).
También es importante el caudal, ya que a menor caudal, un porcentaje relativamente mayor del sustrato se convertirá en producto. El tamaño de los electrodos y la distancia entre ellos son otros factores que influyen.
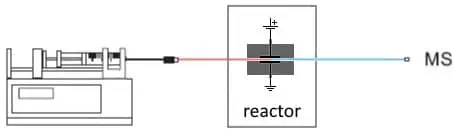
Fig. 2. Configuración más básica para EC/MS. Una bomba de jeringa suministra el sustrato. En el reactor EC se forman productos de oxidación o reducción que se analizan en un MS.
Espectrometría de masas
Los productos de la reacción se analizan en el espectrómetro de masas. Este acoplamiento en línea tiene varias ventajas. En primer lugar, es realmente rápido. Normalmente, en 15 segundos los productos de la reacción se analizan por EM. En segundo lugar, el disolvente es mucho más limpio que con métodos alternativos. Los métodos tradicionales suelen requerir la adición de productos químicos o enzimas, y es necesario un paso de limpieza antes del análisis en una EM. En tercer lugar, con una configuración en línea es más fácil automatizar un flujo de trabajo o utilizar un flujo de reposición y añadir sustratos o ajustar el pH del disolvente y mejorar la sensibilidad de la EM.
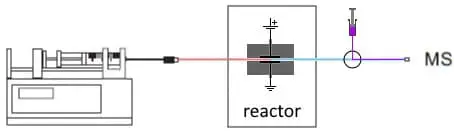
Fig. 3. Configuración EC/MS en línea para estudiar la conjugación. Después del reactor se añade un flujo de reposición con sustrato.
Estudios de metabolitos farmacéuticos
A la derecha se muestra un ejemplo de EC/MS de amodiaquina (AQ). La traza m/z de AQ desaparece y las trazas de metabolitos aparecen cuando se enciende el reactor. En 5 minutos se encuentran e identifican todos los metabolitos conocidos de AQ. Encontrará más detalles en nuestra nota de aplicación.
La técnica ofrece una rápida síntesis electroquímica de metabolitos de fármacos para su identificación y cuantificación por espectrometría de masas (EM). La técnica puede utilizarse en una configuración de flujo continuo, lo que permite su aplicación en un flujo de trabajo automatizado o como sistema de cribado de alto rendimiento.
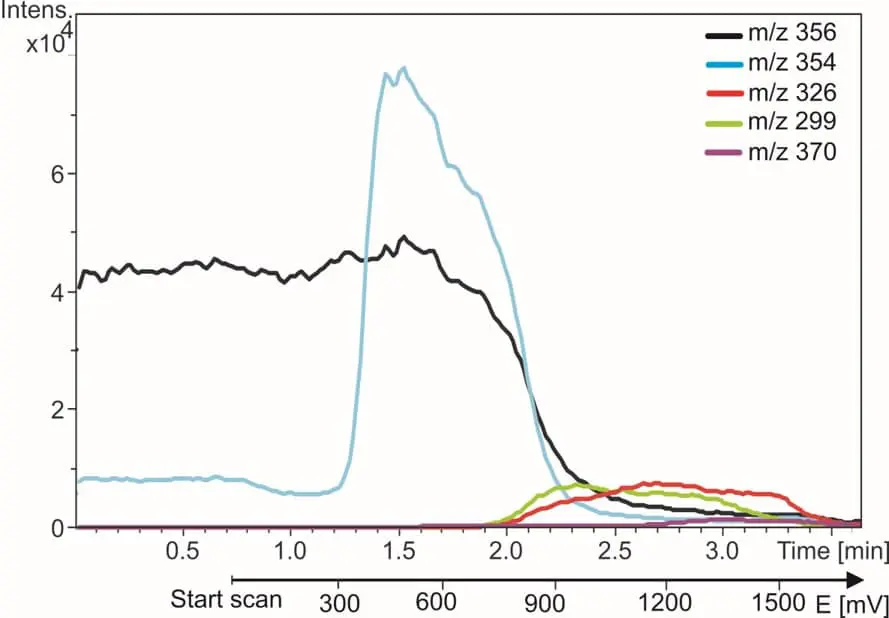
Fig. 3. Fármaco antipalúdico amodiaquina (traza negra) y sus productos de oxidación. Las trazas de m/z se controlan mientras el potencial del reactor se incrementa de 0 a 2 voltios.
Elucidación de la estructura de las proteínas
Otro campo de aplicación de la EC/MS es el de la investigación biofarmacéutica, en rápido crecimiento. Los biofármacos son medicamentos que se producen en sistemas vivos mediante biotecnología. Se trata de proteínas complejas de elevado peso molecular, como las proteínas de fusión, las proteínas de bioafinidad, los anticuerpos (mAbs) y los conjugados anticuerpo-fármaco (ADC).
Con el creciente número de productos biofarmacéuticos que aparecen en el mercado, crece la demanda de estrategias eficaces y automatizadas para la elucidación estructural. Esto puede ser todo un reto. No sólo es importante la estructura primaria, el mapa de aminoácidos. También se refiere a la estructura de orden superior (EOH) definida por puentes disulfuro internos y modificaciones postraduccionales como fosforilaciones, acetilaciones y glucosilaciones, etc. La estructura es lo que define la actividad biológica (revisión: D. Virág et al, 2020).
Los enlaces disulfuro en las proteínas proporcionan estabilidad y plegamiento, por lo que tienen una importancia clave para la funcionalidad biológica. En los anticuerpos monoclonales, por ejemplo, los enlaces disulfuro mantienen unidas las cadenas pequeña y pesada. Por lo tanto, es importante verificar la localización y la conectividad de los disulfuros en las proteínas terapéuticas. Esto suele hacerse reduciendo los enlaces disulfuro y analizando los cambios en los espectros MS (revisión: J. Lakudb et al, 2018).
La reducción electroquímica puede automatizar este flujo de trabajo utilizando un reactor EC en una configuración en línea en conexión con un MS. Se trata de un paso pequeño pero significativo en el reto de la elucidación estructural de los biofármacos(C. Cramer at al, 2015).

Fig. 5. Los enlaces disulfuro (amarillo) desempeñan un papel importante en la estructura de un anticuerpo.
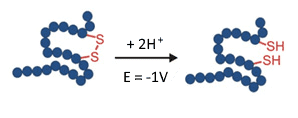
Fig. 6. Reducción (ruptura) de un enlace disulfuro en un reactor EC a -1 V.
Aplicaciones
Véase también una grabación en vídeo de la presentación de la ASMS del profesor Uwe Karst (2010) y una animación por ordenador en la que se compara el método tradicional frente al método EC/MS para estudios de metabolitos.