Électrochimie avec détection MS
Réacteur pour EC/MS
Le couplage en ligne de l’électrochimie (EC) avec la spectrométrie de masse (MS) a montré un grand potentiel pour l’étude du métabolisme des médicaments dans les produits pharmaceutiques et pour l’élucidation de la structure des produits biopharmaceutiques et des protéines. Comme son titre l’indique, cette technique se compose de deux parties. Tout d’abord, le réacteur électrochimique où les produits ou métabolites sont formés. Deuxièmement, l’MS où les produits sont identifiés et dans certains cas quantifiés.

Fig. 1. Une pompe seringue et un potentiostat avec un réacteur EC à l’intérieur.
Réacteur électrochimique
Dans un réacteur électrochimique à flux continu, une solution de substrat est introduite au moyen d’une pompe à seringue. Le réacteur est en fait une cellule électrochimique, un petit potentiel est appliqué sur les électrodes pour entraîner la réaction. La sortie de la cellule est couplée à un MS pour l’analyse des produits.
Plusieurs paramètres sont importants pour la réussite d’une expérience EC/MS. Le premier est le potentiel appliqué, il fournit l’énergie nécessaire pour qu’une réaction se produise. Un potentiel positif pour les réactions d’oxydation et négatif pour les réactions de réduction. Une fois que les conditions sont établies et que la réaction se produit, augmenter encore le potentiel n’accélérera pas la réaction et ne générera pas plus de produit. La raison en est expliquée dans les lois traditionnelles de l’électrochimie. Le facteur limitant n’est pas le potentiel, c’est la diffusion du substrat de la solution à l’électrode.
Le deuxième paramètre important est la composition du solvant. La valeur du pH et le pourcentage en solvant organique peuvent avoir une grande influence. Pour la réduction des protéines par exemple, l’acide formique est utilisé pour fixer le pH. Mais aussi parce qu’il engendre un intermédiaire réactif qui catalyse la réaction, décrite plus en détail par B. Stocks et J. Melanson (2019).
De plus, le débit est important, typiquement à un débit plus faible, un pourcentage relativement plus important du substrat sera converti en produit. La taille des électrodes et l’espacement entre les électrodes sont d’autres facteurs qui jouent un rôle.
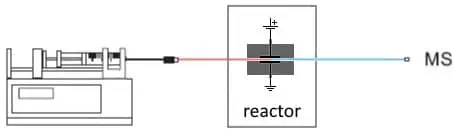
Fig. 2. Configuration la plus basique pour EC/MS. Une pompe à seringue fournit le substrat. Dans le réacteur EC, des produits d’oxydation ou de réduction sont formés et analysés dans un MS.
Spectrométrie de masse
Les produits de la réaction sont analysés dans le spectromètre de masse. Ce couplage en ligne présente plusieurs avantages. Tout d’abord, il est très rapide. En général, les produits de la réaction sont analysés par MS en moins de 15 secondes. Ensuite, le solvant est beaucoup plus propre qu’avec les autres méthodes. Les méthodes traditionnelles nécessitent souvent l’ajout de produits chimiques ou d’enzymes, et une étape de nettoyage est nécessaire avant l’analyse dans un MS. Troisièmement, avec une configuration en ligne, il est plus facile d’automatiser un flux de travail, ou d’utiliser un flux d’appoint et d’ajouter des substrats ou d’ajuster le pH du solvant et d’améliorer la sensibilité du MS.
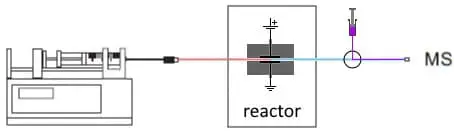
Fig. 3. Configuration EC/MS en ligne pour étudier la conjugaison. Un flux d’appoint avec du substrat est ajouté après le réacteur.
Études sur les métabolites pharmaceutiques
Sur la droite montre un exemple d’EC/MS de l’amodiaquine (AQ). La trace m/z de l’AQ disparaît et les traces des métabolites apparaissent lorsque le réacteur est mis en marche. En 5 minutes, tous les métabolites connus de l’AQ sont trouvés et identifiés. Vous trouverez plus de détails dans notre note d’application.
Cette technique permet la synthèse électrochimique rapide de métabolites de médicaments en vue de leur identification et de leur quantification par spectrométrie de masse (SM). La technique peut être utilisée dans une configuration à flux continu, ce qui permet de la mettre en œuvre dans un flux de travail automatisé ou comme système de criblage à haut débit.
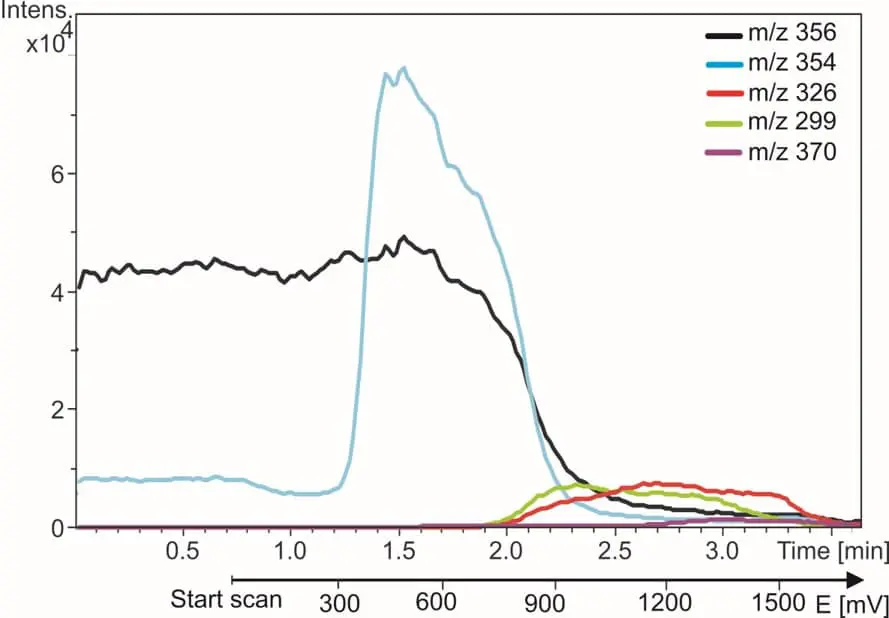
Fig. 3. L’amodiaquine, médicament anti-malaria (trace noire) et ses produits d’oxydation. Les traces m/z sont surveillées pendant que le potentiel du réacteur est incrémenté de 0 à 2 volts.
Élucidation de la structure des protéines
Un autre domaine d’application de l’EC/MS est celui de la recherche biopharmaceutique, qui connaît une croissance rapide. Les produits biopharmaceutiques sont des médicaments qui sont produits dans des systèmes vivants grâce à la biotechnologie. Il s’agit de protéines complexes de poids moléculaire élevé, telles que les protéines de fusion, les protéines de bioaffinité, les anticorps (mAbs) et les conjugués anticorps-médicaments (ADC).
Avec le nombre croissant de produits biopharmaceutiques apparaissant sur le marché, il existe une demande croissante de stratégies efficaces et automatisées pour l’élucidation structural. Cela peut être un véritable défi. Ce n’est pas seulement la structure primaire, la cartographie des acides aminés qui est importante. Elle concerne également la structure d’ordre supérieur (HOS) définie par les ponts disulfures internes et les modifications post-traductionnelles telles que les phosphorylations, les acétylations, les glycosylations, etc. La structure est ce qui définit l’activité biologique (revue : D. Virág et al, 2020).
Les liaisons disulfures dans les protéines assurent la stabilité et le reploiement, et sont donc d’une importance capitale pour la fonctionnalité biologique. Dans les anticorps monoclonaux, par exemple, les liaisons disulfure maintiennent ensemble la chaine lourde et la chaine légère. Il est donc important de vérifier la localisation et la connectivité des disulfures dans les protéines thérapeutiques. Cela se fait généralement en réduisant les liaisons disulfure et en analysant les changements dans les spectres MS (revue : J. Lakudb et al, 2018).
La réduction électrochimique peut automatiser cette tâche en utilisant un réacteur EC couplé en ligne avec un MS. Il s’agit d’une petite mais importante étape dans le défi de l’élucidation de la structure des produits biopharmaceutiques(C. Cramer at al, 2015).

Fig. 5. Les liaisons disulfures (en jaune) jouent un rôle important dans la structure d’un anticorps.
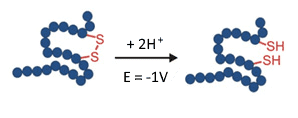
Fig. 6. Réduction (rupture) d’une liaison disulfure dans un réacteur EC à -1 V.
Applications
Voir également un enregistrement vidéo de la présentation de l’ASMS par le professeur Uwe Karst (2010) et une animation informatique comparant la méthode traditionnelle et la méthode EC/MS pour les études de métabolites.