Ingénierie des anticorps
Ingénierie des anticorps par électrochimie
- Réduction, conjugaison et réoxydation électrochimiques des anticorps
- Technologie verte – des électrons au lieu de produits chimiques toxiques
- Sélectif – génère des chaînes légères et lourdes
- Rapide – quelques secondes contre des heures avec les approches chimiques (par ex. TCEP, DTT)
Cette nouvelle approche électrochimique fournit une méthode rapide et efficace pour la réduction, la conjugaison et la réoxydation sélectives des anticorps sans avoir besoin de produits chimiques réducteurs. La réduction des anticorps en chaînes légères (Lc) et en chaînes lourdes (Hc) est réalisée par la méthode électrochimique précédemment publiée, basée sur des impulsions de potentiel à onde carrée appliquées à l’électrode de Ti exclusive d’Antec. Ensuite, la cystéine libre générée par la réduction électrochimique de l’anticorps peut être conjuguée. Enfin, la cystéine libre sur Lc et Hc peut être très rapidement et sélectivement ré-oxydée pour reformer l’anticorps avec un rendement élevé. Le traitement électrochimique n’a pas affecté l’affinité de liaison des anticorps, tout en éliminant le besoin de produits chimiques agressifs et les étapes de nettoyage fastidieuses supplémentaires.
Pour plus de détails : voir aussi notre page sur la technologie.
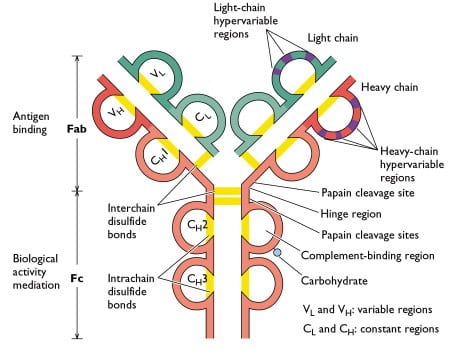
Représentation graphique d’un anticorps dont les chaînes lourdes et légères sont reliées par des liaisons disulfure. La rupture d’une liaison disulfure dans un réacteur électrochimique à circulation continue nécessite un potentiel d’environ -1 V.
Spectres de masse
La réduction électrochimique des liaisons disulfure devrait s’avérer être une avancée technologique majeure non seulement dans l’analyse des anticorps mais aussi dans la conception de nouvelles thérapeutiques basées sur les anticorps, comme les anticorps bi-spécifiques ou les conjugués anticorps-médicament. Les spectres MS ci-dessous montrent les produits de la réaction (Lc et Hc) après la mise en marche de la cellule du réacteur (B et D).
Infusion d’une solution d’anticorps acidifiée dans le spectromètre de masse avec le μ-PrepCell éteint (A) a donné lieu à une enveloppe de charges s’étalant entre m/z 2200 et 4000, l’anticorps intact portant environ 40 à 60 charges. Quand la cellule a été allumée (B), un déplacement de l’enveloppe de charge de l’anticorps vers les m/z inférieurs (~1000-2500) a été observé.
Le spectre (C) résulte de la déconvolution du signal MS (A) obtenu avec la cellule OFF et confirme que l’anticorps est intact. D a été obtenu avec la cellule allumée, et montre principalement des espèces avec des poids moléculaires d’environ 25 et 50 kDa correspondant aux masses de Lc et Hc. La très faible intensité du signal MS pour les espèces dont le poids moléculaire est supérieur à 50 kDa confirme également la réduction sélective des liaisons disulfures inter-chaînes des anticorps à haut rendement.
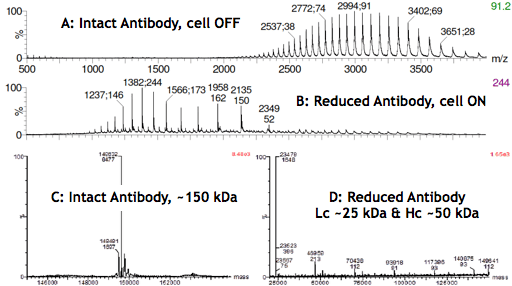
Spectres de masse à haute résolution d’un anticorps monoclonal avant/après réduction électrochimique des liaisons disulfure.
Essai de liaison ELISA
Les courbes obtenues en ELISA pour trois anticorps différents – sous forme native (vert), réduits électrochimiquement et ré-oxydés (rouge et bleu) – montrent un excellent accord, illustrant que le traitement électrochimique des anticorps n’affecte pas leur activité de liaison ni leur activité biologique, même en conservant l’anticorps réduit pendant plusieurs heures en milieu acide.
Courtoisie : données aimablement fournies par le Dr Xin Cheng et Arielle Verdi (Morphotek Inc., Exton, PA).

Évaluation de l’affinité de liaison du ligand par ELISA.
Réacteurs électrochimiques pour la MS et la synthèse
Métabolisme des médicaments
Dégradation de l'environnement
Lipidomique, oxydation des lipides
Notes d’application
Posters