Supérieur HDX-MS
Réduction électrochimique des produits biopharmaceutiques
- Réduction rapide et efficace des liaisons disulfure
- Augmentation de la couverture des séquences en HDX/MS
- Caractérisation améliorée de la région charnière des anticorps, des nœuds de cystine et d’autres protéines riches en cystine
- Ne pas affecter l’échange en retour
- Des électrons au lieu de produits chimiques toxiques
L’échange hydrogène-deutérium (HDX) est utilisé pour étudier la structure tertiaire des protéines, ou le repliement des protéines. Les régions extérieures de la protéine repliée subissent un échange facile d’hydrogène (H) par du deutérium (D). Dans les étapes suivantes du flux de travail, les protéines sont dépliées et la séquence d’acides aminés est élucidée par SM. Les acides aminés contenant du deutérium proviennent évidemment de la région extérieure de la protéine repliée. Pour obtenir des résultats fiables, il est important que la réaction d’échange H/D soit arrêtée (quenchée), et que les changements soient préservés, une fois que le dépliage des protéines et les étapes suivantes ont lieu.
La réduction électrochimique contrôlée des liaisons S-S a été appliquée avec succès pour le dépliage de protéines plus grandes telles que les anticorps, remplaçant ainsi la réduction chimique brutale qui compromettait souvent l’échange H/D. L’utilisation d’agents réducteurs classiques tels que le DTT ou le TCEP est souvent inefficace dans des conditions de quenching (pH acide et basse température). Par conséquent, l’utilisation de ROXY EC avec ses électrodes exclusives à base de titane pour le clivage doux et contrôlé de la liaison S-S ouvre de nouvelles possibilités dans les flux de travail HDX/MS, ce qui permet d’obtenir une couverture de séquence nettement supérieure.
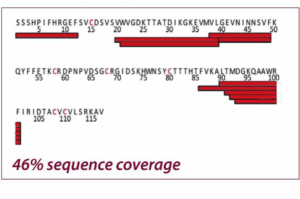
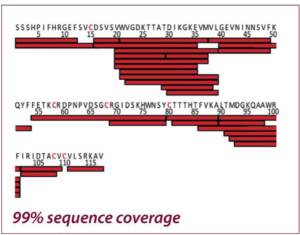
Les deux figures montrent la couverture de la séquence du Nerve Growth Factor-β avec réduction chimique et électrochimique (EC). L’intégration de la cellule à flux électrochimique dans le flux de travail HDX/MS a donné lieu à une couverture de séquence beaucoup plus élevée que la réduction chimique (99 % contre 46 %), permettant une caractérisation beaucoup plus complète du NGF. Adapté de Trajberg E. et al., Anal. Chem.87 (2015) 8880.
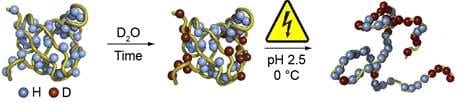
Deutération, suivie d’une réduction du lien disulfure dans le flux de travail de HDX-MS.
Réacteurs électrochimiques pour la MS et la synthèse
Métabolisme des médicaments
Dégradation de l'environnement
Lipidomique, oxydation des lipides
Notes d’application
Posters